Hà Nội: Thu hồi lô thuốc điều trị tăng huyết áp kém chất lượng
Cụ thể, lô thuốc thu hồi là thuốc viên nén Enalapril 5mg (Enalapril maleat 5mg), SÐK: VD-28725-18, lô sản xuất: 012021, ngày sản xuất: 091021, hạn dùng: 091024, do Công ty TNHH MTV 120 Armepharco, số 118 Vũ Xuân Thiều, phường Phúc Lợi, quận Long Biên, Hà Nội sản xuất. Thuốc Enalapril 5mg có tên quốc tế chung là Enalapril, thuộc nhóm thuốc chống tăng huyết áp nhóm thuốc ức chế men chuyển angiotensin.
Enalapril còn có khả năng giảm bớt lượng aldosteron huyết thanh, nhờ đó giảm bớt tình trạng giữ natri của cơ thể và tăng cường hệ giãn mạch kallikrein - kinin, giúp thay đổi sự chuyển hóa của prostanoid, đồng thời ức chế hệ thần kinh giao cảm.
Ở bệnh nhân bị tăng huyết áp, Enalapril 5mg hỗ trợ giảm huyết áp thông qua giảm bớt sức cản trên toàn bộ ngoại vi, kèm theo đó là hiện tượng tăng ít hoặc không tăng về tần số tim, lưu lượng tim và lưu lượng tâm thu. Thuốc cũng hỗ trợ giãn động mạch và tĩnh mạch.
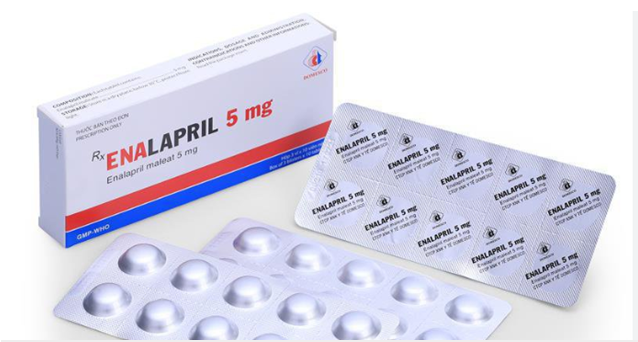
Sở Y tế Hà Nội đã yêu cầu Giám đốc Công ty TNHH Dược phẩm Huy Thịnh (Quầy 214, số 1 Nguyễn Huy Tưởng, Thanh Xuân, Hà Nội), Công ty TNHH MTV 120 Armepharco thu hồi triệt để lô thuốc trên do không đạt tiêu chuẩn chất lượng về chỉ tiêu độ hòa tan và định lượng. Phạm vi thu hồi là trên địa bàn Hà Nội và các cơ sở đã mua lô thuốc này từ Công ty TNHH Dược phẩm Huy Thịnh. Công ty phải gửi báo cáo thu hồi, hồ sơ thu hồi theo quy định.
Các cơ sở y tế công lập trực thuộc ngành, cơ sở y tế ngoài công lập, doanh nghiệp kinh doanh thuốc, cơ sở bán lẻ thuốc trên địa bàn khẩn trương rà soát, thu hồi lô thuốc không đạt tiêu chuẩn chất lượng nêu trên.
Trung tâm Kiểm soát bệnh tật TP. Hà Nội đăng thông tin và phối hợp với cơ quan truyền thông thông tin tới các cơ sở kinh doanh, sử dụng thuốc và người dân biết để không buôn bán, sử dụng.
Mới đây, Cục Quản lý Dược (Bộ Y tế) cũng vừa phát cảnh báo về thuốc kháng sinh Cephalexin 500 giả xuất hiện trên thị trường, yêu cầu truy tìm nguồn gốc, xử lý vi phạm.
Như đã đưa tin trước đó, Viện kiểm nghiệm thuốc TP HCM đã báo cáo về mẫu sản phẩm nghi làm giả thương hiệu của Công ty cổ phần dược phẩm Cửu Long, có các thông tin ghi nhãn: viên nang cứng Cephalexin 500, số lô 04310322, ngày sản xuất 31/03/22, hạn dùng 31/02/25, nơi sản xuất là Công ty cổ phần dược phẩm Cửu Long ở Phường 5, TP Vĩnh Long.
Cụ thể, mẫu do Trung tâm kiểm nghiệm Vĩnh Long lấy tại nhà thuốc Ngọc Thanh Thanh ở huyện Bình Tân, tỉnh Vĩnh Long, không đạt yêu cầu chất lượng về chỉ tiêu định tính Cephalexin. Căn cứ dữ liệu cấp phép lưu hành thuốc của Cục Quản lý Dược, không có sản phẩm thuốc nào đã được cấp phép lưu hành có các thông tin nêu trên.
Để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược đề nghị Sở Y tế tỉnh Vĩnh Long khẩn trương phối hợp với cơ quan công an, quản lý thị trường, Ban chỉ đạo 389 và các cơ quan chức năng liên quan thanh kiểm tra Nhà thuốc Ngọc Thanh Thanh (tổ 3, khóm Tân Lợi, thị trấn Tân Quới, huyện Bình Tân, tỉnh Vĩnh Long).
Và các đơn vị có liên quan, truy tìm nguồn gốc của lô hàng ghi nhãn Viên nang cứng Cephalexin 500 như trên. Tiến hành xử lý cơ sở vi phạm theo quy định. Báo cáo kết quả thanh tra, kiểm tra, xử lý về Cục Quản lý Dược.
Đơn vị triển khai thực hiện các hoạt động theo tinh thần Công văn số 1729/QLD- CL ngày 24/2/2023 của Cục Quản lý Dược về việc thông báo thuốc giả, thuốc không rõ nguồn gốc.
Chỉ đạo các đơn vị chức năng tăng cường công tác thanh tra, kiểm tra (định kỳ và đột xuất) việc thực hiện các quy chế chuyên môn về dược của các cơ sở sản xuất, kinh doanh, sử dụng thuốc trên địa bàn.
Kịp thời phát hiện, ngăn chặn và xử lý nghiêm theo qui định đối với các trường hợp kinh doanh thuốc giả, thuốc không rõ nguồn gốc, thuốc nhập lậu, thuốc mua bán không có hóa đơn chứng từ hợp lệ.
Thanh Hà