Mỹ tiếp tục thu hồi thuốc mỡ mắt thương hiệu Delsam Pharma do nguy cơ nhiễm trùng
Mới đây, FDA đã khuyến cáo về việc sử dụng các sản phẩm thuốc mỡ mắt nhân tạo có thể dẫn đến nguy cơ nhiễm trùng, thậm chí mù lòa. Đồng thời báo cáo thêm về một số bao bì sản phẩm bị thu hồi đang trong tình trạng rò rỉ hoặc hư hỏng.
Thông tin cần biết về việc thu hồi thuốc mỡ mắt nhân tạo
Theo thông tin của FDA, thuốc mỡ mắt nhân tạo bị thu hồi có dạng tuýp 3,5 gam, chứa 15% dầu khoáng, 83% xăng dầu trắng và có chức năng làm chất bôi trơn và làm dịu khô mắt.
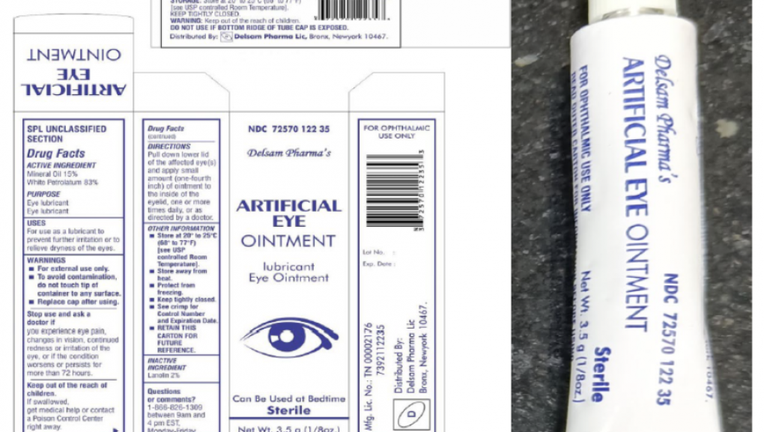
Sản phẩm thuộc Lô số H29, được đóng gói trong ống nhôm màu trắng và đựng trong hộp giấy, có Mã thuốc quốc gia (NDC) là 72570-122-35 và mã vạch UPC là 3 72570 012235 3. Loại thuốc này được phân phối trên toàn quốc tại Hoa Kỳ và được bán trực tuyến trên trang chủ Delsam.
FDA cho biết, Global Pharma Healthcare đã thông báo Delsam Pharma về việc thu hồi và đang yêu cầu các nhà bán buôn, bán lẻ cũng như khách hàng ngừng sử dụng và loại bỏ các sản phẩm bị ảnh hưởng.
Người dùng được khuyến nghị gặp ngay bác sĩ và báo cáo với FDA nếu gặp bất kỳ triệu chứng nào liên quan đến sản phẩm.
Global Pharma Healthcare cũng cho biết cho đến nay công ty chưa nhận được bất kỳ báo cáo nào về tác dụng phụ liên quan đến thuốc.
Sự việc thuốc nhỏ mắt có liên quan các ca nhiễm trùng, tử vong trước đó
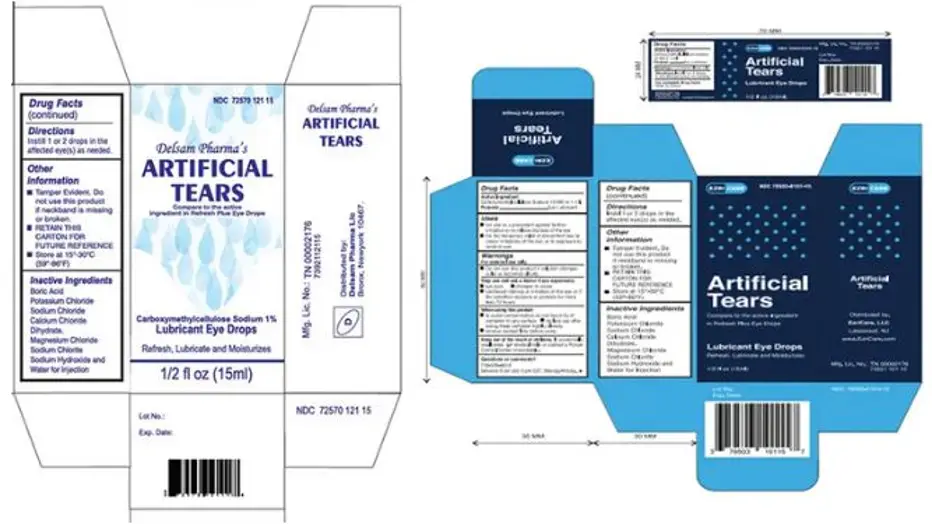
Global Pharma Healthcare thu hồi tất cả các lô Thuốc nhỏ mắt bôi trơn nước mắt nhân tạo do EzriCare, LLC và Delsam Pharma cung cấp trước nguy cơ bị nhiễm khuẩn. (Nguồn: FDA)
Vào ngày 2/2/2023, Global Pharma cũng đã thu hồi tất cả các lô thuốc nhỏ mắt nhân tạo chưa hết hạn sử dụng do 2 hãng dược phẩm EzriCare và Delsam Pharma phân phối sau khi có liên quan đến đợt bùng phát bệnh nhiễm trùng vi khuẩn ở nhiều bang.
Trung tâm kiểm soát và phòng ngừa dịch bệnh (CDC) Hoa Kỳ trước đó đã gửi một cảnh báo sức khỏe tới các bác sĩ, cho biết đợt bùng phát có ít nhất 55 người ở 12 tiểu bang nhiễm bệnh, trong đó có 1 ca tử vong và ít nhất 5 người bị mất thị lực vĩnh viễn.
Các trường hợp nhiễm trùng được tìm thấy trong máu, nước tiểu và phổi, có liên quan đến sản phẩm Nước mắt nhân tạo EzriCare. Nhiều người cho biết đã sử dụng loại nhỏ mắt này để điều trị kích ứng và khô mắt.
Thuốc nhỏ mắt thương hiệu EzriCare được sản xuất tại Ấn Độ bởi Global Pharma Healthcare. FDA khuyến nghị thu hồi sản phẩm dựa trên các vấn đề trong quy trình sản xuất bao gồm thiếu thử nghiệm và còn sai sót trong khâu đóng gói.
Cơ quan này cũng chặn nhập khẩu sản phẩm vào Hoa Kỳ.
Điều tra chỉ ra rằng các ca nhiễm trùng được gây ra bởi một loại vi khuẩn gọi là Pseudomonas aeruginosa có trong những lọ thuốc EzriCare đã mở. Song các nhà điều tra vẫn đi đến có kết luận cuối cùng và tiếp tục tiến hành các thử nghiệm.
EzriCare, công ty tiếp thị thuốc nhỏ mắt tại Hoa Kỳ, nói rằng chưa bất kỳ bằng chứng chắc chắn các trường hợp nhiễm trùng và thuốc nhỏ mắt có liên quan đến nhau. Tuy nhiên, phía công ty đã ngừng phân phối cũng như thông báo trên trang web kêu gọi người tiêu dùng ngưng sử dụng sản phẩm này.
Hàng loạt các bang California, Colorado, Connecticut, Florida, New Jersey, New Mexico, New York, Nevada, Texas, Utah, Washington và Wisconsin đều có bệnh nhân bị chuẩn đoán nhiễm trùng. Trong đó đã có một người ở Washington tử vong do nhiễm trùng máu.
Các quan chức cho biết đợt bùng phát số người nhiễm trùng đặc biệt đáng lo ngại vì vi khuẩn có khả năng kháng lại các loại kháng sinh tiêu chuẩn.
Hoàng Ngân